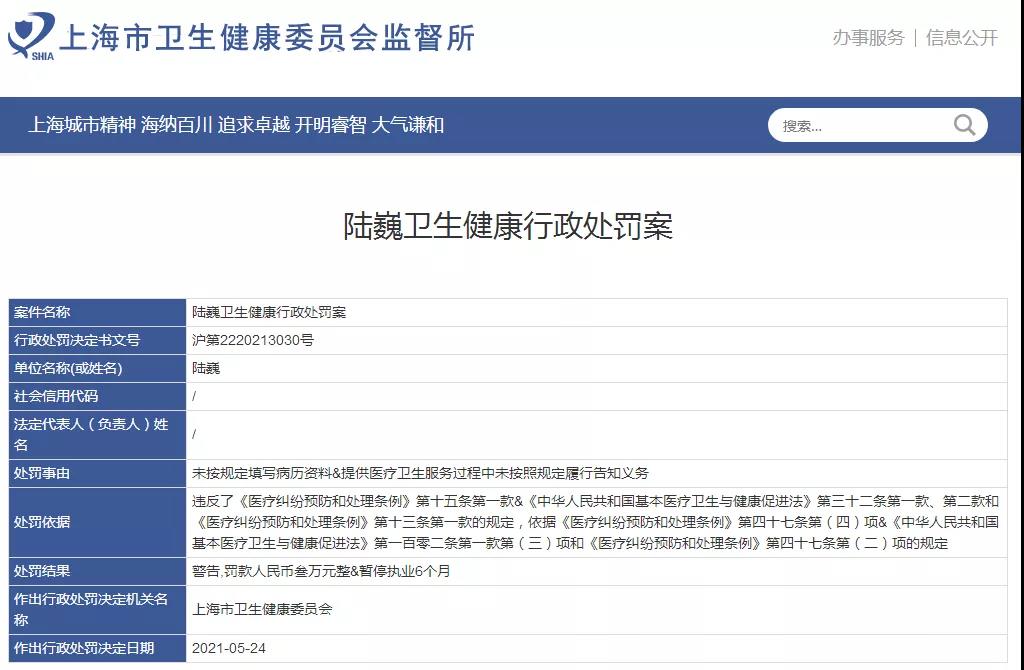
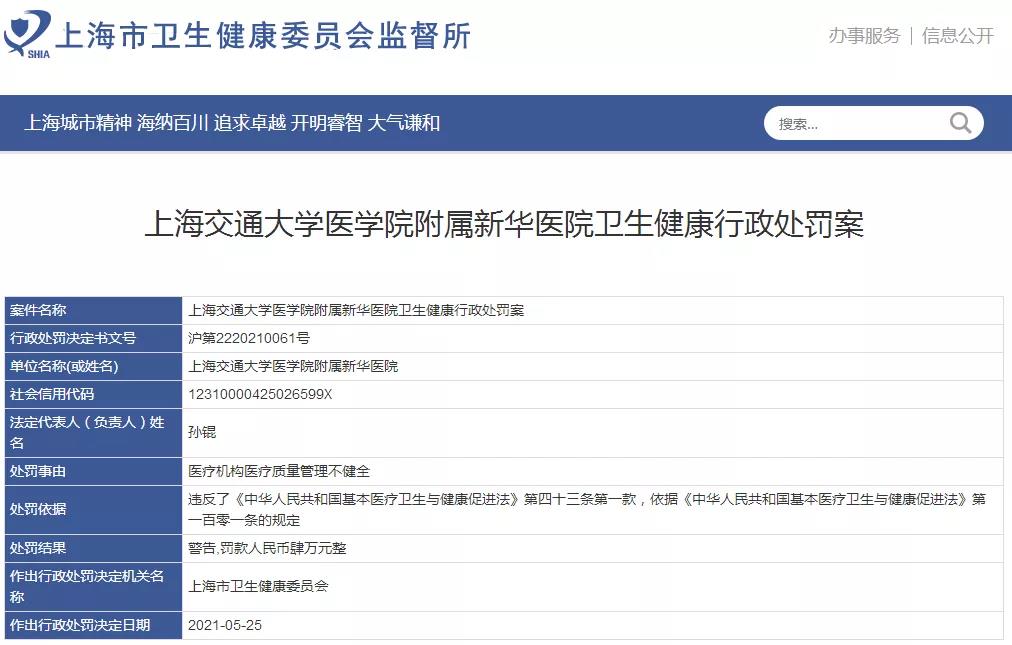
5月28日,上海市衛健委監督所官方網站公布了“腫瘤治療黑幕”涉事(shì)醫生陸巍的相關處罰結果。處罰信息顯示,對(duì)陸巍處以“警告,罰款人民币叁萬元整,暫停執業6個月”的處罰。處罰的事(shì)由爲“未按規定填寫病曆資料,提供醫療衛生服務過(guò)程中未按照規定履行告知義務”。對(duì)上海交通大學(xué)醫學(xué)院附屬新華醫院處以“警告,罰款人民币肆萬元整”的處罰。處罰事(shì)由是:醫療機構醫療質量管理不健全。
并且,因“未取得醫療機構執業許可證擅自執業”,上海嘉慷生物工程有限公司被處以“處罰沒(méi)收違法所得15萬元,罰款人民币150萬元;罰沒(méi)款合計165萬元”的處罰。
4月18日晚,北京大學(xué)第三醫院醫生張煜在某平台發(fā)表一篇題爲《寫給我摯愛的國(guó)家和衆多的腫瘤患者和家屬——請與我一起(qǐ)呼籲,請求國(guó)家盡早設立醫療紅線,遏制腫瘤治療中的不良醫療行爲》的推文。文中指出上海某三甲醫院普外科醫生陸巍蓄意誘導治療,導緻患者馬進(jìn)倉花費了常規治療10倍以上的資金,其中包括做NGS基因測序,接受了“NK細胞療法”、濫用輔助用藥等,結果人财兩(liǎng)空。
對(duì)于此次事(shì)件的處理結果,雖然涉事(shì)醫生、醫院和企業都(dōu)受到了處罰,但仍有許多問題沒(méi)有得到解決,醫生與細胞公司之間是否有利益輸送?醫院對(duì)這(zhè)些事(shì)是否知情?這(zhè)些混亂是怎麼(me)造成(chéng)的?如何解決?
究竟什麼(me)是細胞療法?
是“收割患者”,還(hái)是“一線希望”
張煜醫生的發(fā)文讓細胞療法再一次走進(jìn)大衆視野。
細胞治療是利用患者自體(或異體)的成(chéng)體細胞(或幹細胞)經(jīng)過(guò)生物工程改造,移植或者輸入患者體内,對(duì)組織、器官進(jìn)行修複的治療方法。
按照細胞種(zhǒng)類,細胞療法可以分爲幹細胞治療和免疫細胞治療,前者廣泛應用于血液類疾病、器官移植、心血管系統疾病、肝髒疾病、神經(jīng)系統疾病、組織創傷等疾病領域。
細胞免疫治療療法包括CAR-T細胞治療、CIK細胞治療、DC-CIK細胞治療、DC細胞治療、NKT細胞治療、ACTL細胞治療等。其中,CAR-T細胞治療全稱嵌合抗原受體T細胞治療,是免疫細胞療法中最有希望攻克腫瘤的療法。目前,全球已有5款CAR-T細胞療法獲FDA批準上市。
對(duì)于張煜醫生提到的NK細胞療法是指通過(guò)采血,提取患者體内的免疫細胞,進(jìn)行體外擴增後(hòu),再回輸注回患者體内,以增強患者免疫力,殺傷腫瘤細胞。但該療法的療效還(hái)未得到驗證,還(hái)屬于臨床研究階段。此前,魏則西生前接受了DC-CIK細胞治療,也還(hái)停留在早期臨床研究階段。
盡管NK療法沒(méi)有獲批用于臨床,但不少從事(shì)NK細胞療法業務的企業商人逐利而行轉入地下,形成(chéng)一條龐大的灰色産業鏈。治療價格更是亂象疊出,一針價格從幾萬到幾十萬不等,一個療程費用可達上百萬元。
根據藥智輿情大數據監控系統顯示,自4月18日張煜醫生發(fā)文以來,”細胞治療“相關話題呈現高度輿情熱度,截至目前,相關數據總量113936條,輿情演化過(guò)程呈現出如下特點:
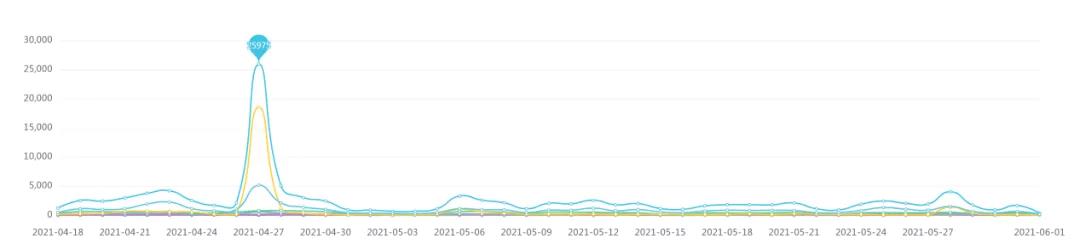
信息來源走勢圖

關鍵詞雲
對(duì)“細胞治療”話題比較關注的除了行業人員及進(jìn)行相關行業投資者,還(hái)有腫瘤等難治性疾病患者及患者家屬。一些非法售賣細胞産品者在各社群鼓吹細胞治療效果,讓一些腫瘤患者或其家屬相信,細胞療法是“放手一搏”的機會(huì)。再引導其私下交易,重金購買他們的産品,患者最終可能(néng)得到了一定的治療效果,但更可能(néng)是人财兩(liǎng)空。
雖然CAR-T、NK細胞療法等療法是當下研發(fā)的熱點,但國(guó)内目前尚無細胞免疫療法獲批上市。國(guó)内進(jìn)度最快的産品是上海複星醫藥與美國(guó)吉利德旗下Kite Pharma成(chéng)立的合資企業複星凱特的阿基侖賽注射液,其上市申請已于今年1月進(jìn)入行政審批階段,但至今仍未獲批。
而地下産業的細胞産品根本無法保證療效。對(duì)于求醫心切的患者,可以關注正規臨床試驗,對(duì)于符合入組條件的可以申請試藥。
細胞治療亂象原因何在?
宜明細胞質量總裁劉雙生認爲,“現在衛健委監管的缺失是造成(chéng)混亂現狀的主要原因。體細胞非法臨床用藥黑幕問題并非上海特有,其它地區也存在。北京大學(xué)第三醫院腫瘤化療科主治醫師張煜先生是一個警示此類違法行爲的吹哨者。”
近年來,細胞/基因等新技術發(fā)展的非常快,需要新的法規支持。自2009年衛生部將(jiāng)基因治療歸入第三類醫療技術目錄開(kāi)始,衛生部的監管缺失造成(chéng)基因、細胞治療産品從此開(kāi)始進(jìn)入混亂的無序狀态。魏則西事(shì)件終止了這(zhè)種(zhǒng)亂象,也使細胞治療發(fā)展陷入低迷狀态。2017年諾華的CAR-T産品獲批上市,重新引起(qǐ)從業者和監管機構的重視。CDE的介入使基因和免疫細胞治療産品的監管得到有序發(fā)展。
但是衛健委出台的兩(liǎng)個文件,《生物醫學(xué)新技術臨床應用管理條件(征求意見稿》和《體細胞治療臨床研究和轉化應用管理辦法(試行)(征求意見稿)》(征求意見稿)又給了一些企業不願走藥監局途徑的企業希望。
劉雙生認爲,雖然衛健委的想法是好(hǎo)的,想讓細胞治療技術能(néng)快速進(jìn)入臨床使患者受益。但衛健委不能(néng)像藥監局那樣擁有完善的審評機制和現場核查機制,不能(néng)像藥監局那樣嚴格監管,導緻衛健委提出的建議難以落地。
基于這(zhè)兩(liǎng)個征求意見稿的不确定性和不可實施性,目前來看這(zhè)兩(liǎng)個文件很可能(néng)已被擱置了,細胞治療産品想走第三類醫療技術這(zhè)條路不太現實,但是國(guó)家可能(néng)會(huì)開(kāi)個别口子,例如針對(duì)兒童罕見病的。但是仍然會(huì)要求遵守GMP原則。
我國(guó)細胞治療産業發(fā)展的主要矛盾是監管體系建設滞後(hòu)于産業發(fā)展速度,國(guó)家正在加大對(duì)細胞治療産業發(fā)展的支持力度。目前,研發(fā)階段相關指導文件基本已落地,但是缺乏指導NDA上市核查标準的政策落地文件,預計也將(jiāng)很快就(jiù)會(huì)落地。
結語
對(duì)于事(shì)件的處理結果,張煜醫生于5月28日中午發(fā)文表示,對(duì)上述行政處罰決定感到“五味雜陳,難以評價”。他寫道(dào),“我的願望很簡單:希望民衆能(néng)得到規範的醫療,不良醫療行爲越來越少。以及我的很多同道(dào),那些踏踏實實爲患者健康努力的醫生,能(néng)夠勞有所得。”
細胞治療在腫瘤、免疫性疾病、神經(jīng)系統疾病、慢性病及罕見病等領域展現了良好(hǎo)的應用前景,是當下生物醫藥研發(fā)最熱門的賽道(dào)之一。一方面(miàn),細胞治療爲疾病治愈帶來了希望,另一方面(miàn),利益的驅使讓這(zhè)個行業變得混亂。非法使用細胞産品者打亂了市場,打擊了正常研究申報者的信心。唯有健全監管機制,規範細胞治療産品研究、臨床試驗及商業化才能(néng)真正造福患者。
----------THE END----------
免責聲明:本文系轉載分享,文章觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!