
前言
中美藥品監管機構通過(guò)設定加快上市程序(Expedited Programs)爲那些具有滿足臨床急需醫療需求潛力或是有充分證據表明優于臨床現有療法的藥品提供了上市加速渠道(dào),以及相應的技術和政策支持。數據表明,上市加速程序的加速效果顯著,其中,NMPA的優先審評審批政策可將(jiāng)藥物審評時(shí)間從406天縮減至77天;FDA的突破性療法認定則可將(jiāng)藥物的開(kāi)發(fā)時(shí)間從8年縮短至4.8年。
爲了加快藥物開(kāi)發(fā)和上市,加速滿足臨床急需醫療需求,包括NMPA、FDA、EMA等在内的各國(guó)藥品監管機構均頒布了相關加快上市程序。其中,NMPA在2020版的《藥品注冊管理辦法》中,設立了“突破性治療藥物、附條件批準、優先審評審批、特别審批”四個加快上市程序,FDA則通過(guò)立法設立了“快速通道(dào)(Fast Track)、突破性療法(Breakthrough Therapy)、再生醫學(xué)先進(jìn)療法(Regenerative Medicine Advanced Therapy)、優先審評(Priority Review)、加速審批(Accelerated Approval)”五個加快上市程序。NMPA在2021年共批準了75個新藥,其中16個新藥通過(guò)優先審評審批和附條件批準加速上市,在獲批的15款國(guó)産創新藥中,更是有高達14款獲得了優先審評審批或附條件批準,同年FDA批準的新藥中則是有71%通過(guò)優先審評批準上市,足以見得申請加快上市程序對(duì)創新藥開(kāi)發(fā)的重要性。
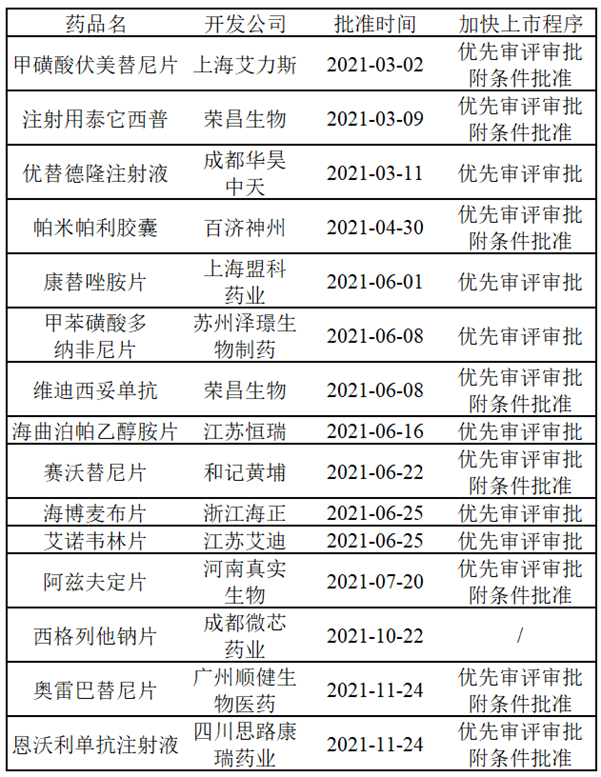
那麼(me)什麼(me)樣的新藥才能(néng)申請到加快上市程序?申請到加快上市程序又能(néng)多大程度地加速新藥上市呢?根據NMPA頒布的《藥品注冊管理辦法》,將(jiāng)加快上市程序的相關特性總結如下:
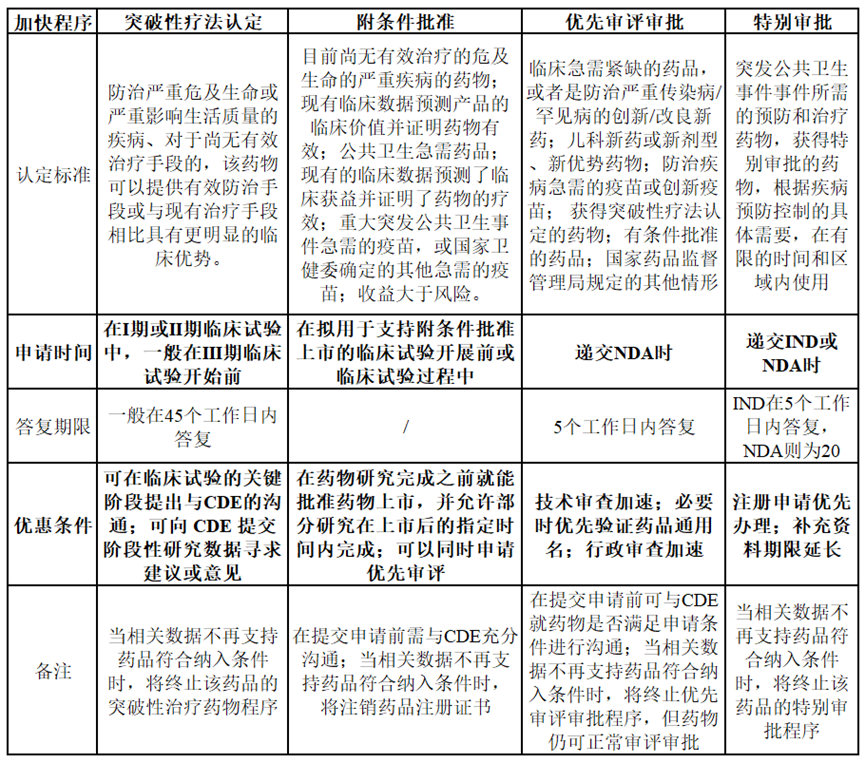
可以發(fā)現,能(néng)夠獲得加快上市的藥物均是具有滿足臨床急需醫療需求的潛力或是有充分證據表明優于臨床現有療法,藥品獲得優先審評審批或突破性療法認定後(hòu),可獲得來自NMPA的政策和技術支持,包括但不限于必要的技術指導、與藥品申請人的溝通、資源的優先分配和縮短審查時(shí)間等。
由百濟神州開(kāi)發(fā)的澤布替尼(zanubrutinib)便是納入加快上市程序的典型。一項入組86例患者的單臂II期臨床試驗結果顯示,在複發(fā)性和/或難治性套細胞淋巴瘤患者中,澤布替尼的ORR率爲83.7%,CR達到78%,房顫、第二腫瘤、腫瘤溶解綜合征的發(fā)生率均爲0,
療效和安全性均優于既往獲批的BTK抑制劑,基于此,澤布替尼先後(hòu)獲得了NMPA的突破性療法認定、優先審評審批以及附條件批準。更早之前同樣也獲得了FDA的突破性療法認定以及加速批準,從遞交NDA申請到加速批準上市僅耗時(shí)5個月。
特别審批程序則主要适用于突發(fā)公共衛生事(shì)件所需藥物,如COVID-19,2021年NMPA審結了81件納入特别審批程序的注冊申請(包括IND和NDA),均爲新冠病毒疫苗和治療藥物,并建議附條件批準5件新冠病毒疫苗NDA。
根據NMPA的2021年度藥品審評報告,我們也能(néng)一探各個加快上市程序申請的成(chéng)功率。NMPA在2021年共受理突破性治療藥物程序的注冊申請263件,批準了其中的53件,成(chéng)功率爲20.1%;受理NDA共389件,其中有115件納入了優先審評審批程序,占比29.5%。可以看出雖然成(chéng)功率并不算高,但相比去年仍有明顯提高,一方面(miàn)說(shuō)明中國(guó)新藥的創新水平正不斷提升,另一方面(miàn)也說(shuō)明藥審中心的審評資源在逐年向(xiàng)具有臨床優勢的新藥注冊申請傾斜。
FDA的加速政策與NMPA的相關政策大同小異,此處不再贅述。對(duì)于藥品申請人來說(shuō),最關心的可能(néng)還(hái)是獲得監管機構的加快上市認定後(hòu),到底能(néng)節約多長(cháng)時(shí)間,可爲自己的産品帶來多大的先發(fā)優勢。
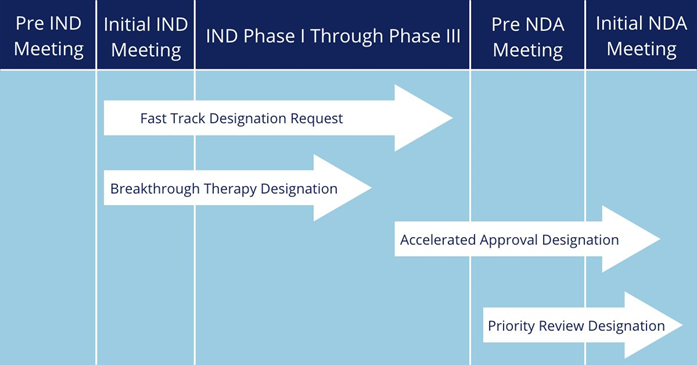
FDA加快上市程序
根據NMPA的規定,納入優先審評審批程序的藥品上市許可申請,審評時(shí)限爲130日,其中臨床急需的境外已上市境内未上市的罕見病藥品審評時(shí)限爲70日,而普通NDA的審評時(shí)限則爲200天。
另外,根據中國(guó)醫學(xué)科學(xué)院腫瘤醫院的研究報告,從2016年到2020年,獲得優先審評審批資格的藥品其中位審評時(shí)間僅爲77天,而對(duì)普通審評審批的藥品說(shuō),遞交NDA後(hòu)耗時(shí)的中位數爲406天,顯著長(cháng)于納入優先審評審批程序的藥品。
其他各國(guó)的藥品監管機構的加快上市程序有著(zhe)類似的效果。對(duì)于未獲得優先審評資格的藥品來說(shuō),
在2021年,從向(xiàng)FDA遞交NDA到獲得批準上市的中位時(shí)長(cháng)爲365天,而優先審評的藥品則可將(jiāng)這(zhè)一時(shí)間縮短123天,大大加速創新藥物的上市及臨床應用。其他國(guó)家/地區如歐盟、日本、加拿大等的優先審評政策也均可縮短藥品審評審批耗時(shí)26%-46%不等。
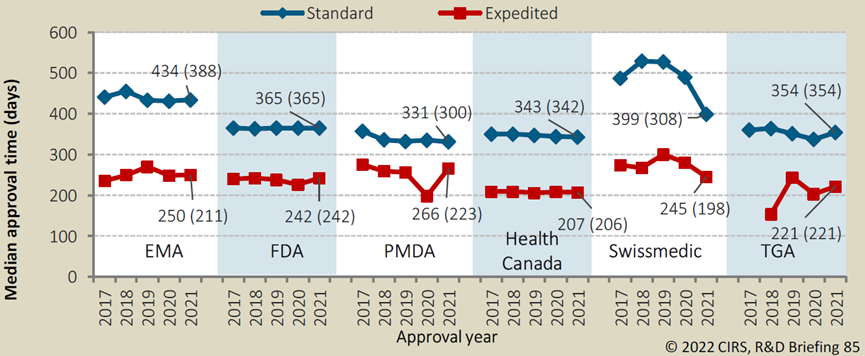
各國(guó)監管優先審評vs普通審評耗時(shí)
事(shì)實上,獲得加快上市相關政策資格後(hòu),藥物的臨床開(kāi)發(fā)時(shí)間同樣可以得到節約。根據發(fā)表在JAMA的相關文章,獲得一項FDA加快上市政策資格的藥品中位開(kāi)發(fā)時(shí)間(從IND申請到FDA首次批準的時(shí)間)爲7.1年,相比沒(méi)有任何加快上市政策資格的藥品縮短了0.9年;盡管優先審評資格能(néng)夠將(jiāng)藥品的審評時(shí)間縮短4個月,但令人詫異的是,對(duì)于非突破性、非快速通道(dào)的藥物,即使納入優先審評或加速批準,他們與未獲得加快上市資格的藥物在開(kāi)發(fā)時(shí)間上并沒(méi)有顯著差異;而對(duì)于被授予突破性療法認定或快速通道(dào)資格的藥品來說(shuō),開(kāi)發(fā)時(shí)間則明顯縮短,他們的中位開(kāi)發(fā)時(shí)間分别隻有4.8年和7.0年,尤其是突破性療法認定,將(jiāng)藥品的開(kāi)發(fā)時(shí)間整整減少了40%,充分體現了突破性療法認定的優勢,更及時(shí)地爲患者送去了急需新藥,也爲藥企赢得了更長(cháng)的上市獨占期。
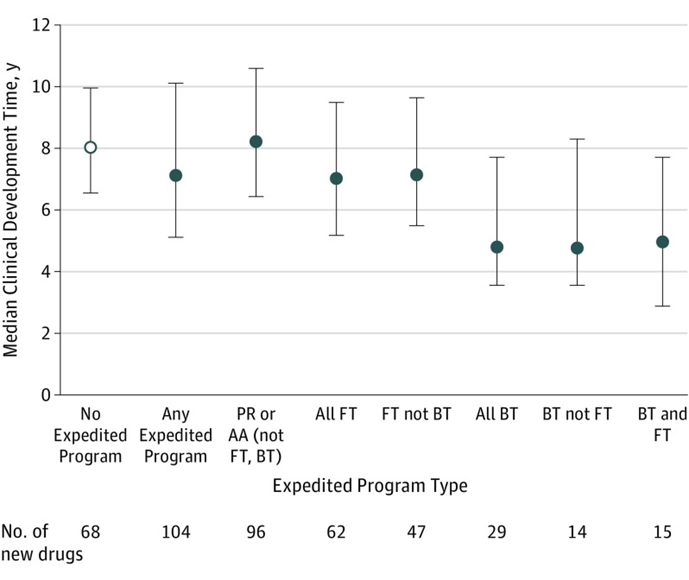
FDA不同加快上市政策的中位開(kāi)發(fā)時(shí)間
參考:
[1] 《Guidance for Industry Expedited Programs for Serious Conditions – Drugs and Biologics》
[2] 《藥品注冊管理辦法》
[3] Wang S, Yang Q, Deng L. An overview of cancer drugs approved through expedited approval programs and orphan medicine designation globally between 2011 and 2020. Drug Discov Today. 2022 May;27(5):1236-1250.
[4] Hwang TJ, Darrow JJ, Kesselheim AS. The FDA's Expedited Programs and Clinical Development Times for Novel Therapeutics, 2012-2016. JAMA. 2017 Dec 5;318(21):2137-2138.
[5] 《2021年度藥品審評報告》
[6] https://www.fda.gov/
----------THE END----------
免責聲明:本文系轉載分享,文章觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!





 FDA不同加快上市政策的中位開(kāi)發(fā)時(shí)間
FDA不同加快上市政策的中位開(kāi)發(fā)時(shí)間