一、細胞治療行業概況
1、細胞治療發(fā)展曆程
CAR-T,即嵌合抗原受體T細胞免疫療法。通過(guò)將(jiāng)識别腫瘤相關抗原在體外進(jìn)行基因重組,通過(guò)病毒侵染嵌合到患者T細胞,使患者T細胞表達腫瘤抗原受體,經(jīng)過(guò)純化和大規模擴增後(hòu)的T細胞,也即CAR-T細胞。
1990s開(kāi)始,科學(xué)家開(kāi)始研發(fā)CAR-T,并且不斷改進(jìn)CAR結構;2017年美國(guó)FDA批準全球首款CAR-T産品上市;2021年,中國(guó)NMPA批準兩(liǎng)款CAR-T上市;2022年2月,中國(guó)企研發(fā)的CAR-T産品cital-cel成(chéng)功在美國(guó)上市銷售。
細胞治療發(fā)展曆史
資料來源:公開(kāi)資料整理
2、免疫細胞療法特點對(duì)比
目前T細胞、NK細胞(自然殺傷細胞)在免疫細胞治療中應用較多。T細胞是目前應用最成(chéng)熟的免疫細胞,具有特異性殺傷腫瘤的作用。腫瘤細胞具有逃避T細胞免疫識别的機制,PD1抗體等免疫檢查點抑制劑類通過(guò)打開(kāi)T細胞識别腫瘤的“開(kāi)關”從而激活T細胞殺傷作用,而基于T細胞的細胞療法則是將(jiāng)天然或強化過(guò)的T細胞輸入進(jìn)人體内殺傷腫瘤。
免疫細胞療法特點對(duì)比

資料來源:公開(kāi)資料整理
二、CAR-T細胞治療産業鏈
細胞治療産業鏈以CAR-T爲例,上遊爲流式細胞儀等設備生産商和用于T細胞分選、轉染等步驟的試劑,以及細胞因子等原、輔料。中、下遊分别爲CAR-T研發(fā)和産品生産企業,其中許多研發(fā)企業也選擇自行制備慢病毒載體,生産CAR-T細胞。
CAR-T細胞治療産業鏈

資料來源:公開(kāi)資料整理
三、全球CAR-T細胞治療行業市場現狀分析
1、CAR-T細胞治療銷售額
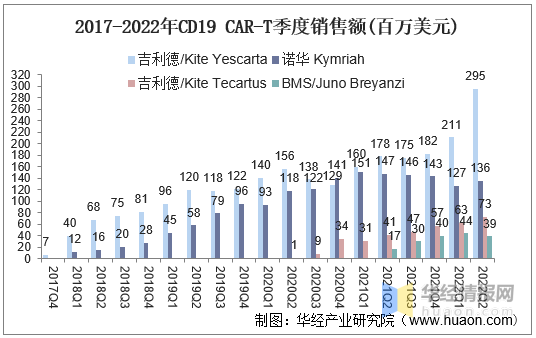
據統計,2021年全球CAR-T産品銷售額合計已達17.1億美元,其中CD19産品合計15.5億美元,CD19CAR-T銷售額逐季增長(cháng)。吉利德的Yescarta2021年銷售額7.0億美元,且2022Q2仍在同比增長(cháng)。此外,吉利德Tecartus及BMS Breyanzi處于銷售爬坡階段。
2017-2022年CD19CAR-T季度銷售額(百萬美元)
資料來源:公開(kāi)資料整理
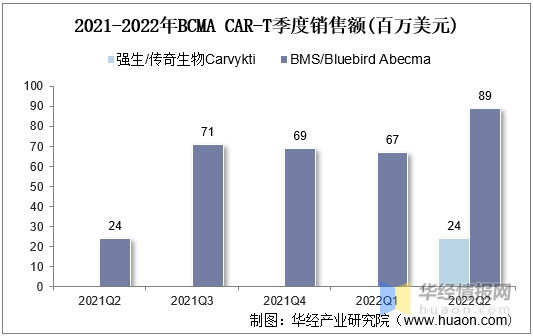
2021年全球BCMA産品合計1.6億美元,目前BCMA CAR-T處于爬坡初期。BMS Abecma2022Q2單季度銷售額8900萬美元,環比增長(cháng)33%。強生/傳奇Carvykti上市首個季度銷售2400萬美元,與Abecma上市首個季度一緻。
2021-2022年BCMACAR-T季度銷售額(百萬美元)
資料來源:公開(kāi)資料整理
2、CAR-T生産成(chéng)本
從Gene&Cell Therapy Insights對(duì)Kite的Yescarta生産成(chéng)本的來看,每劑CAR-T生産成(chéng)本爲58200美元,其中人工成(chéng)本占比最高爲71%,耗材成(chéng)本爲18%,廠房設備成(chéng)本爲12%。
CAR-T生産成(chéng)本拆分(單位:%)
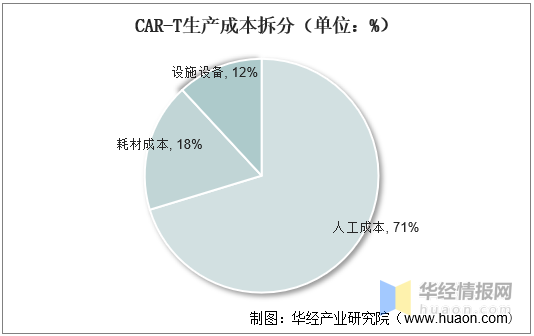
資料來源:CELL&GENE THERAPY INSIGHTS,華經(jīng)産業研究院整理
四、中國(guó)CAR-T細胞治療行業市場現狀分析
1、市場空間
國(guó)内市場方面(miàn),我國(guó)細胞治療市場空間將(jiāng)由2021年的13億元增長(cháng)至2030年的584億元,年均增速高達53%。其中CAR-T細胞療法市場空間將(jiāng)由2021年的3億元增長(cháng)至2030年的288億元;其他細胞治療市場空間將(jiāng)由2021年的10億元增長(cháng)至2030年的297億元。
2021-2030年國(guó)内CAR-T細胞治療市場空間預測
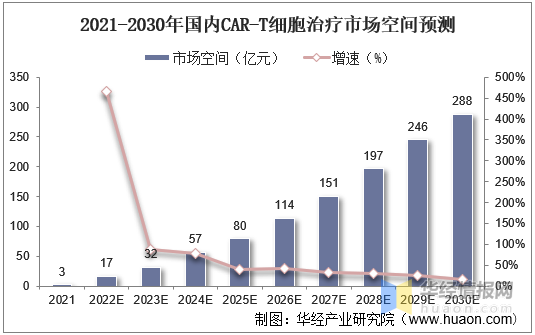
資料來源:公開(kāi)資料整理
2、專利情況
随著(zhe)CAR-T細胞治療技術熱度上升,越來越多的企業開(kāi)始進(jìn)入該領域,市場競争愈發(fā)激烈,專利布局作爲市場競争的有力武器,各公司對(duì)CAR-T細胞治療技術專利布局更加重視,近年來CAR-T細胞治療技術專利申請呈現爆發(fā)式增長(cháng)。我國(guó)CAR-T細胞治療技術起(qǐ)步較晚,直到2011年才開(kāi)始有相關專利申請,2015年後(hòu),随著(zhe)全球專利申請數量的快速攀升,我國(guó)CAR-T細胞治療領域專利申請也有較大程度的增長(cháng),2016年後(hòu)專利年申請量超過(guò)400件。
2011-2021年我國(guó)CAR-T細胞治療技術專利申請趨勢
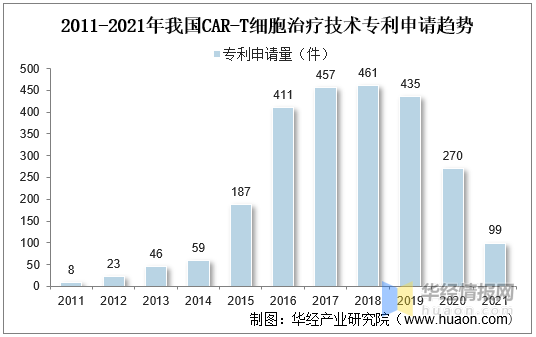
資料來源:知識産權出版社有限責任公司,華經(jīng)産業研究院整理
從我國(guó)CAR-T細胞治療專利技術來源地分布來看,上海市是我國(guó)CAR-T細胞治療技術發(fā)展最爲突出的城市,上海細胞治療集團、上海恒潤達生生物科技有限公司、上海邦耀生物科技有限公司、上海優卡迪生物醫藥科技有限公司、科濟生物醫藥(上海)有限公司、亘喜生物科技(上海)有限公司都(dōu)在CAR-T細胞治療領域積極探索并實施專利布局策略。
上海市是我國(guó)CAR-T細胞治療技術發(fā)展最爲突出的城市,上海細胞治療集團、上海恒潤達生生物科技有限公司、上海邦耀生物科技有限公司、上海優卡迪生物醫藥科技有限公司、科濟生物醫藥(上海)有限公司、亘喜生物科技(上海)有限公司都(dōu)在CAR-T細胞治療領域積極探索并實施專利布局策略。
國(guó)内CAR-T細胞治療專利技術來源地
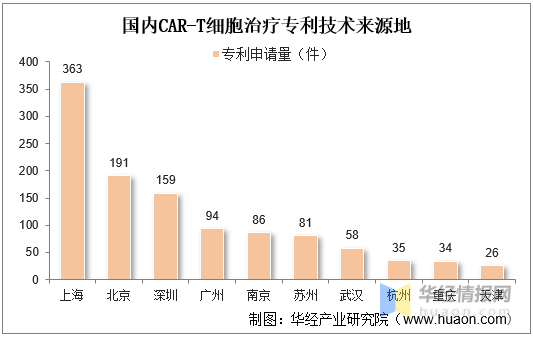
資料來源:知識産權出版社有限責任公司,華經(jīng)産業研究院整理
在我國(guó)專利申請TOP30申請人中,有17位是我國(guó)本土申請人,10位是美國(guó)申請人,另外3位申請人分别來自瑞士、法國(guó)和英國(guó)。CAR-T細胞治療領域中國(guó)專利申請人中,深圳賓德生物技術有限公司、賓夕法尼亞大學(xué)、百時(shí)美施貴寶專利申請數量位居前三位,是中國(guó)CAR-T細胞治療專利技術最具優勢的創新主體,而諾華公司、上海細胞治療集團、美國(guó)衛生和人力服務部在中國(guó)也具有非常明顯的CAR-T細胞治療專利優勢。
中國(guó)CAR-T細胞治療專利申請人Top30(件)
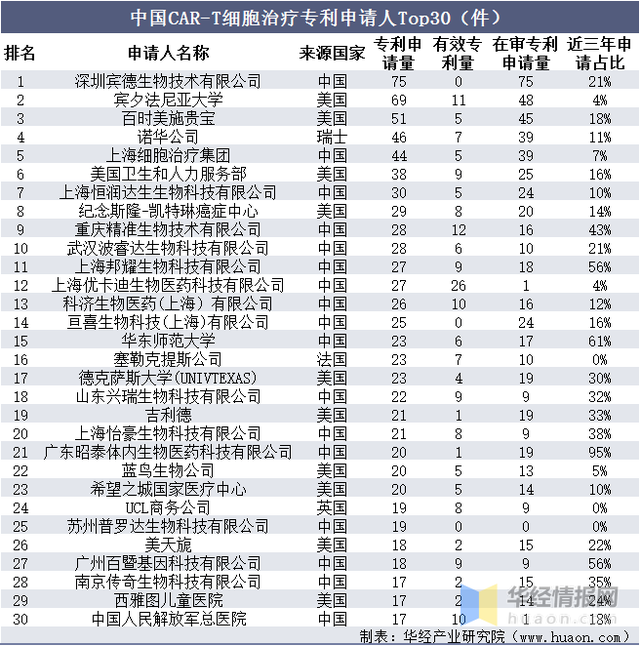
資料來源:知識産權出版社有限責任公司,華經(jīng)産業研究院整理
五、CAR-T細胞治療行業競争格局分析
1、現有CAR-T銷售現狀
2017年,諾華第一款CAR-T藥物上市,啓動細胞治療商業化的大門,至今已有六款細胞治療藥物上市:①前四款都(dōu)是選擇CD19爲治療靶點,後(hòu)兩(liǎng)是BCMA;②目前治療領域集中在血液瘤,更多藥企在逐步開(kāi)展實體瘤研發(fā);③目前CAR-T均爲自體細胞療法,通用型産品仍在研發(fā)當中。國(guó)内企業進(jìn)展迅速,複星凱特、藥明巨諾的産品均在國(guó)内上市;傳奇生物額cital-cel成(chéng)功在美國(guó)上市。
現有CAR-T療法售價及2021年銷售額
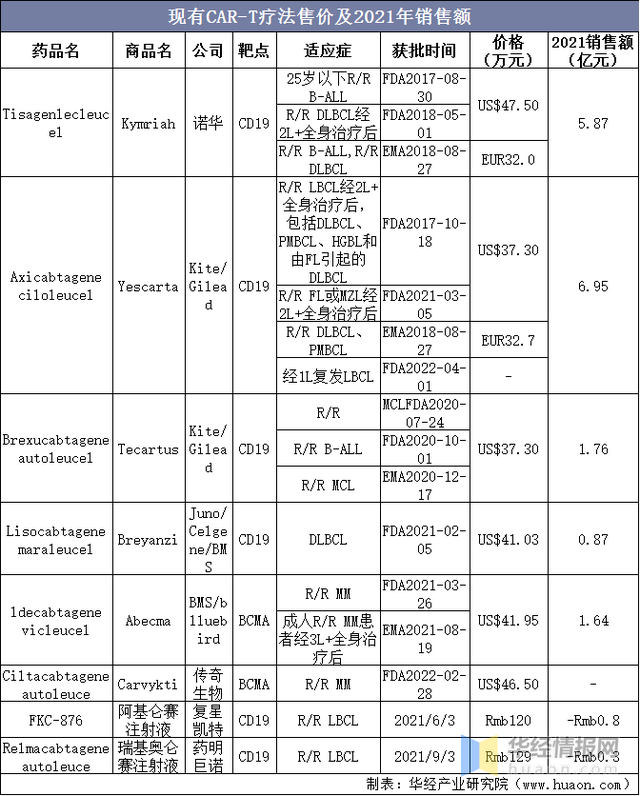
資料來源:FDA,各公司公告,華經(jīng)産業研究院整理
2、國(guó)内研發(fā)現狀
國(guó)内已批準複星凱特、藥明巨諾等2款靶向(xiàng)于CD19的CAR-T療法,而信達生物/馴鹿醫療的BCMACAR-T療法正在申請上市,此外美國(guó)已批準傳奇生物開(kāi)發(fā)的BCMACAR-T。
中國(guó)企業CAR-T國(guó)内臨床研發(fā)管線數量(單位:款)
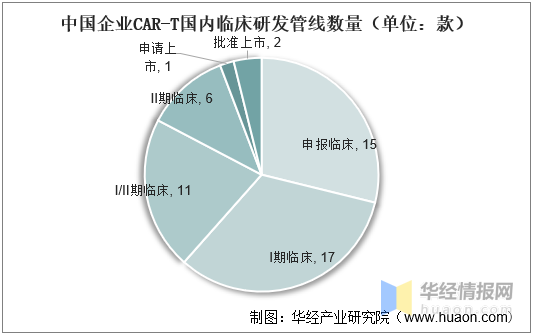
資料來源:公開(kāi)資料整理
目前我國(guó)企業在國(guó)内開(kāi)展的CAR-T臨床管線主要集中于CD19與BCMA,也有一些公司在新靶點上做出突破,如科濟藥業在CLDN18.2的胃癌實體瘤中展現CAR-T療法的初步療效。
中國(guó)企業CAR-T國(guó)内臨床研發(fā)管線靶點分布
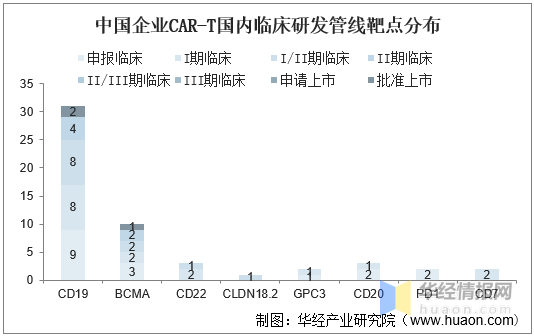
資料來源:公開(kāi)資料整理
3、國(guó)内細胞治療CRO/CDMO主要公司
我國(guó)基因細胞治療CRO/CDMO公司快速崛起(qǐ)。涉及上市公司主要有藥明康德、金斯瑞生物科技、和元生物、博騰股份,非上市公司主要有宜明細胞、派真生物、五加和、譜新細胞、阿思科力、源興基因等。
中國(guó)基因細胞治療CRO/CDMO主要公司
 /p>
/p>
資料來源:公開(kāi)資料整理
六、CAR-T細胞治療展望
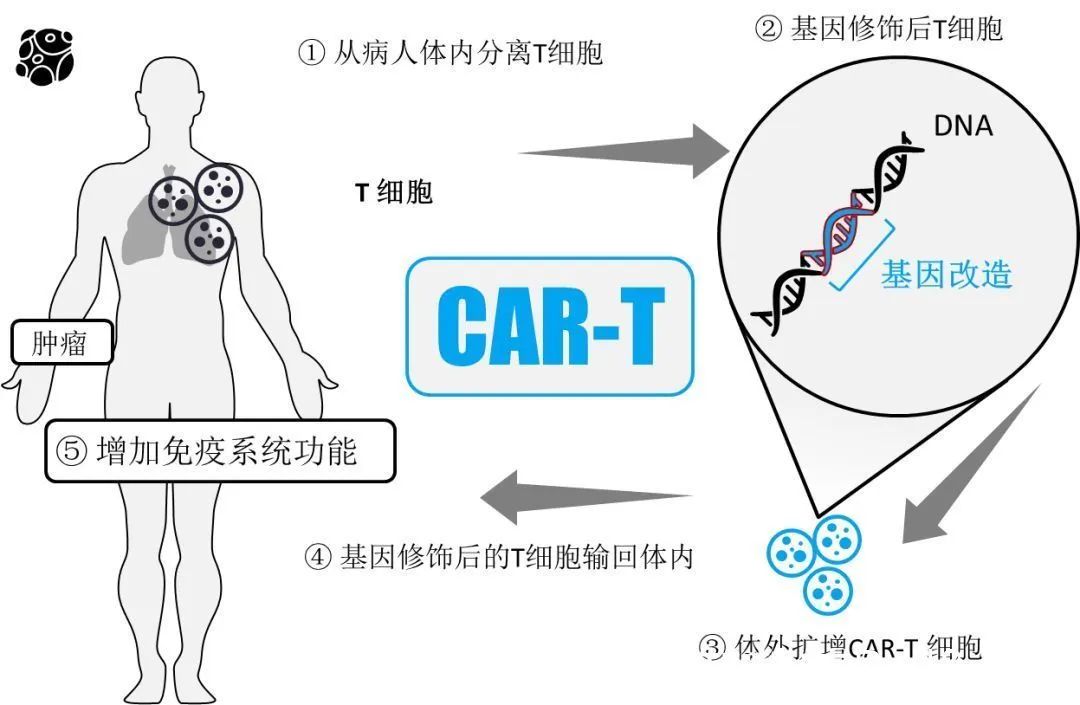
當前,CAR-T治療尚處于發(fā)展的初級階段,還(hái)存在幾個重要難題亟待解決:CRS和ICANS等不良反應;腫瘤相關抗原逃逸導緻癌症複發(fā)(如CD19逃逸);在慢性白細胞白血病和非霍奇金淋巴瘤中需要提高效應活力;在實體瘤中表現未達預期;通用型CAR-T還(hái)未真正走向(xiàng)臨床,前幾代的CAR-T治療成(chéng)本過(guò)于高昂。
目前,全球共有5款CAR-T産品已經(jīng)在美國(guó)獲批上市,但這(zhè)些産品價格在35萬~50萬美元,一般患者根本無法承擔。目前臨床應用的大多數CAR-T屬于第二代,而第三代、第四代CAR-T以及有望規模化生産以降低成(chéng)本的通用性CAR-T的臨床應用案例較少,未來降低CAR-T成(chéng)本的制備生産必定是CAR-T療法的重要發(fā)步階段,尚無比較完善的監管體系,也缺乏相關的指導和參考,這(zhè)導緻不同單位生産出來的CAR-T質量參差不齊,甚至同一家單位生産出來的産品也存在較大的差異性。
在臨床試驗方面(miàn),我國(guó)有超過(guò)20家機構正在進(jìn)行CAR-T産品的臨床申報,這(zhè)些還(hái)不包括在國(guó)家衛生健康委員會(huì)備案直接進(jìn)行細胞治療的醫院以及在國(guó)外進(jìn)行CAR-T産品申報的企業。如果沒(méi)有完善的醫保政策支持及相應的政策指導,動辄數百萬元人民币的治療費用以及一系列不可控的臨床治療風險終將(jiāng)會(huì)使腫瘤患者望而卻步。
來源:求實藥社
----------THE END----------
免責聲明:本文系轉載分享,文章觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!