撰文:北雨
IF= 78.5
推薦度:⭐⭐⭐⭐⭐
亮點:
1、在本綜述中,作者讨論了癌症起(qǐ)源的主要理論及其基礎因素的相對(duì)重要性;
2、作者提出,更好(hǎo)地理解這(zhè)些過(guò)程將(jiāng)提高早期診斷癌症的能(néng)力,并在疾病較容易控制且治療相對(duì)廉價且相對(duì)無害的階段進(jìn)行更精确的治療。
第一部分 背景介紹
Part One ──────────────────
2023年7月24日,英國(guó)劍橋大學(xué)的研究人員在 Nature 子刊(Nature Reviews Cancer)發(fā)表了題爲:Cancers make their own luck: theories of cancer origins的綜述論文。

治療任何疾病都(dōu)需要了解疾病組織中的生物學(xué)機制。
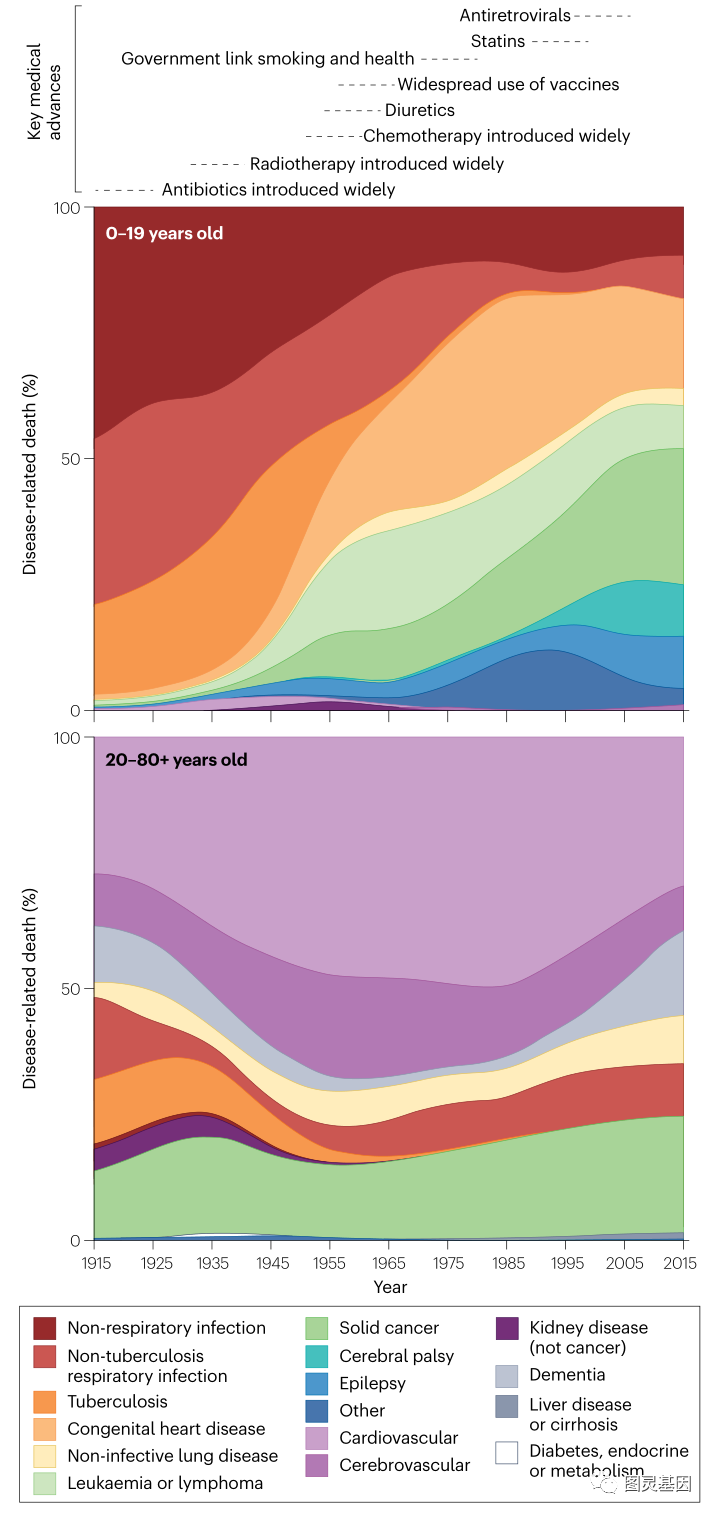
圖片:導緻疾病相關死亡的主要原因
在19世紀和20世紀初,傳染病是導緻死亡的主要原因。20世紀上半葉癌症已成(chéng)爲一個重要的殺手。發(fā)現可以殺死快速分裂細胞的化學(xué)物質開(kāi)啓了癌症化療領域的發(fā)展,對(duì)癌基因的理解開(kāi)啓了分子靶向(xiàng)治療領域的發(fā)展,對(duì)癌症與免疫系統之間相互作用的理解開(kāi)啓了免疫治療領域的發(fā)展。
盡管取得了這(zhè)些進(jìn)展,癌症仍然是導緻疾病死亡的主要原因。盡早檢測以及治療癌症或其前體將(jiāng)顯著提高患者的生存率,同時(shí)降低治療的侵入性、成(chéng)本和副作用。
在本綜述中,將(jiāng)讨論癌症起(qǐ)源的主要理論以及内外因素在惡性轉變中的相對(duì)貢獻。更好(hǎo)地理解這(zhè)些過(guò)程將(jiāng)提高早期診斷癌症的能(néng)力,并在疾病較容易控制且治療相對(duì)廉價且相對(duì)無害的階段進(jìn)行更精确的治療。
第二部分 癌症起(qǐ)源的理論
Part Two ──────────────────
不同風險因素暴露和預期壽命的差異導緻全球癌症類型的異質性;但癌症不是一個随機過(guò)程,而是受到發(fā)育和衰老組織中可複現的決定因素的支配。這(zhè)一點在兒童和成(chéng)年人惡性腫瘤的比較中最爲明顯。
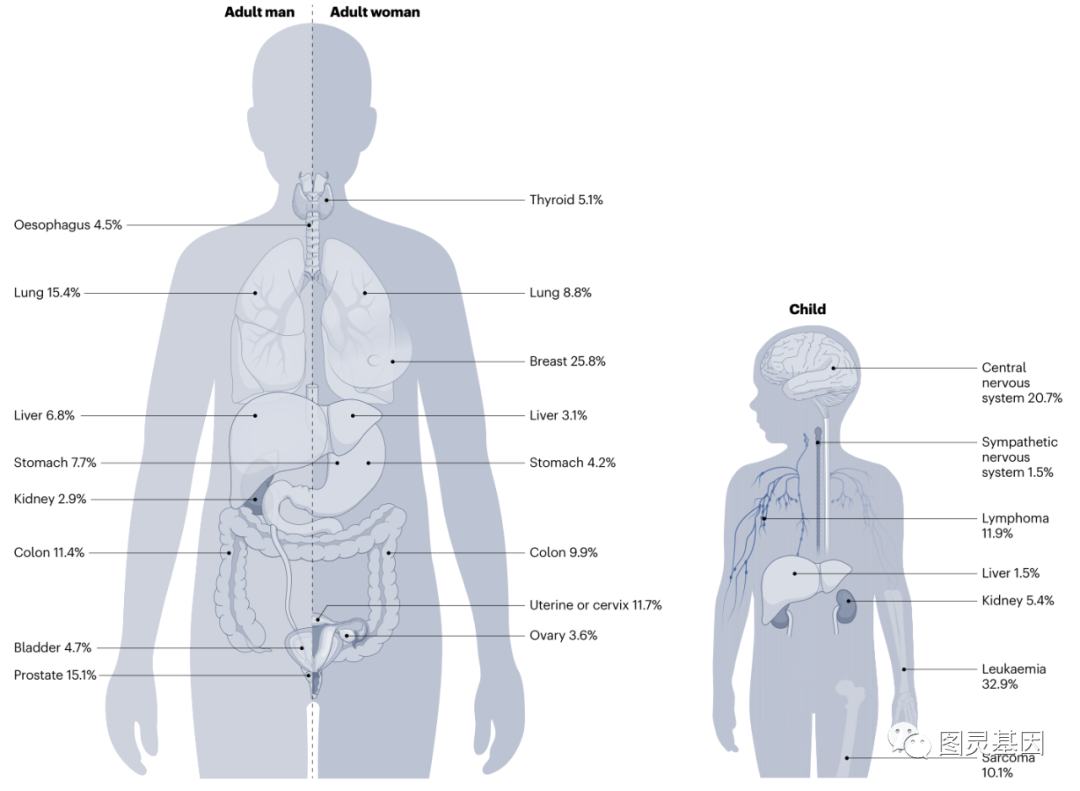
圖片:常見人類癌症的器官部位(成(chéng)人&兒童)
癌症發(fā)病率随年齡增加的觀察結果可以用癌症體細胞突變理論來解釋。然而,某些結果與該理論不符,包括兒童和成(chéng)年腫瘤的自發(fā)性或激素驅動的退縮,注入到囊胚中的惡性畸胎瘤的正常化,以及許多緻癌物并不損害DNA的證據。
其他學(xué)者提出了癌症組織結構域理論。組織結構域理論認爲,整個組織是緻癌物的靶點,擾亂了實質和間質或基質之間的生物物理和生物力學(xué)交流。因此,正常組織結構的增殖和運動限制喪失,引發(fā)進(jìn)行性的上皮變質、異型增生和癌變。
最近,又提出了兩(liǎng)種(zhǒng)理論——“壞運氣”理論和“基态”理論,它們借鑒了體細胞突變理論和組織結構域理論的概念。
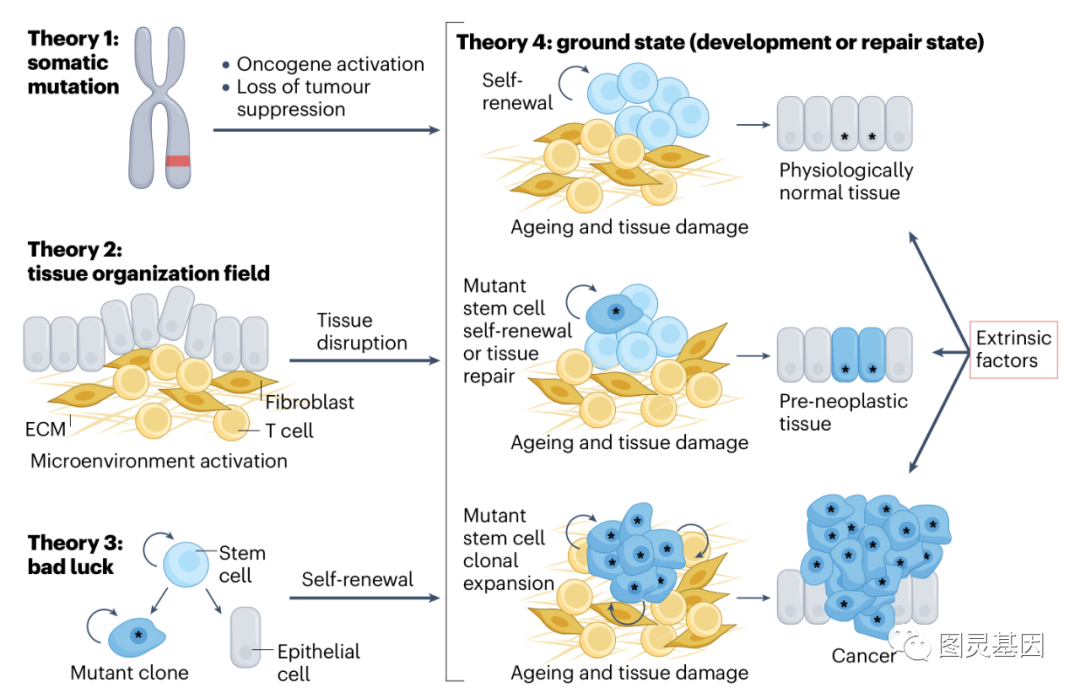
圖片:癌症起(qǐ)源的主要理論
1.“壞運氣”理論
在一個模型中提出,幹細胞DNA複制過(guò)程中發(fā)生的随機錯誤(R突變)導緻了突變克隆的必然傳播,從而導緻癌症。該模型將(jiāng)R突變與遺傳性突變(H突變)或環境緻癌物引起(qǐ)的突變(E突變)區分開(kāi)來。通過(guò)將(jiāng)癌症發(fā)病率與相應宿主組織中幹細胞分裂的估計率進(jìn)行比較,計算出多達三分之二的緻癌突變是R突變。
盡管與體細胞突變理論類似,但“壞運氣”理論是重要的(所謂的“壞運氣”是因爲R突變和幹細胞分裂是組織的必然特征),因爲它提供了一個概念框架來理解H、E和R因素對(duì)癌症風險的相對(duì)貢獻。
但是“壞運氣”理論存在問題,這(zhè)一理論的基本原則是以突變爲中心,假設外部因素僅通過(guò)E突變而不是其他過(guò)程影響癌症風險。然而,癌症風險在時(shí)間和地理上有所變化,這(zhè)種(zhǒng)變化不僅僅可以歸因于分裂幹細胞的偶然突變。此外,假設癌症風險完全由幹細胞分裂數目決定,不能(néng)充分解釋其他細胞内在(例如,表觀遺傳狀态)或外在(例如,免疫微環境)因素對(duì)癌症易感性的調節,這(zhè)些因素可能(néng)與細胞分裂無關。
支持“壞運氣”理論的數據的相關技術問題存在一定限制,相關方法沒(méi)有考慮到與年齡和非惡性疾病相關的幹細胞狀态的變化,而這(zhè)可能(néng)會(huì)影響癌症風險。
2.“基态”理論
作者提出了一種(zhǒng)癌症起(qǐ)源理論,該理論側重于細胞的功能(néng)狀态(即其“基态”),而不是細胞的分類。這(zhè)個概念容納了細胞可塑性的概念,即發(fā)育、衰老和損傷因素可以在不依賴細胞分裂的情況下改變細胞對(duì)轉化的敏感性。
這(zhè)個理論符合一個觀察結果,即許多緻癌物質并不具有誘變性,而與細胞分裂無關的突變過(guò)程對(duì)體細胞突變具有重要貢獻。
基态理論建立在 “壞運氣”理論和組織結構域理論的基礎上,強調外部和内部因素的融合形成(chéng)驅動癌症的細胞狀态。通過(guò)這(zhè)種(zhǒng)方式考慮癌症起(qǐ)源,能(néng)夠在流行病學(xué)研究的基礎上,開(kāi)發(fā)出有效的癌症預防、早期診斷和幹預策略。
作者從直接觀察到的基因工程小鼠模型中提出了“基态”理論。
新生兒的幹細胞對(duì)轉化的抵抗力比成(chéng)年人高7倍。新生兒對(duì)癌症的抵抗不依賴于幹細胞增殖、器官部位和突變的終身持續性。因此,癌症風險不僅僅是突變幹細胞增殖的必然後(hòu)果,還(hái)受到幹細胞中與年齡相關、與增殖無關的變量的影響。
對(duì)胚胎、新生兒和成(chéng)年造血幹細胞(HSCs)的比較,表明未成(chéng)熟幹細胞相對(duì)抵抗轉化。
帶有緻癌突變的靜止成(chéng)年幹細胞很少發(fā)生轉化,但在組織損傷修複時(shí)很容易産生癌症。因此,除了發(fā)育因素外,細胞外、環境的損害可能(néng)將(jiāng)細胞的基态轉變爲修複和增殖狀态,進(jìn)而影響癌症風險。
與“壞運氣”理論類似,支持基态理論的觀察結果也存在一些限制。然而,各種(zhǒng)癌症起(qǐ)源理論提出的概念和問題爲探讨癌症風險的決定因素和癌症預防的機會(huì)提供了幫助。
3.癌症起(qǐ)源的不同理論之間存在共同要素
癌症起(qǐ)源的各種(zhǒng)理論強調了組織轉化所需的不同要素。現有證據表明,每個要素都(dōu)對(duì)癌症起(qǐ)源有所貢獻,盡管它們的相對(duì)重要性可能(néng)因細胞環境和癌症類型而異。
細胞易感狀态
并非身體中的每個細胞都(dōu)會(huì)産生癌症。細胞易感狀态的存在證明了在兒童和成(chéng)年人中出現不同癌症以及癌症在身體中的非随機分布。盡管這(zhè)些模式部分受到暴露于風險因素的差異的影響,但也是因爲特定細胞在特定位置、特定時(shí)間處于易感癌變的“基本狀态”。這(zhè)個概念包括細胞可塑性的概念,即發(fā)育、衰老或損傷因素重塑細胞的表觀遺傳和轉錄組,從而形成(chéng)可轉化狀态。
DNA異常
DNA序列的變化(例如點突變、擴增和易位)會(huì)激活癌基因的功能(néng),或者使抑癌基因失活(例如無義突變或缺失),對(duì)細胞轉化至關重要。DNA異常是癌症起(qǐ)源的所有主要理論中的重要要素。癌基因和抑癌基因被認爲主要影響癌症表型的基本方面(miàn),如細胞增殖和侵襲。DNA異常具有更廣泛的影響:重塑表觀遺傳組來生成(chéng)可轉化、可塑的細胞狀态,并與細胞外因素(包括組織損傷)共同作用,産生有利于轉化的獨特表觀遺傳狀态。
細胞外因素
這(zhè)一要素在組織結構域理論和基态理論中是核心,但在體細胞突變和“壞運氣”理論中強調較少。這(zhè)些因素包括從物理突變原到感染性因素和組織損傷等衆多因素。一個常見的主題是這(zhè)些因素能(néng)夠誘導上皮轉化,從而顯著改變細胞可塑性并增加惡性轉化的風險。
第三部分 細胞内在因素
Part Three ──────────────────
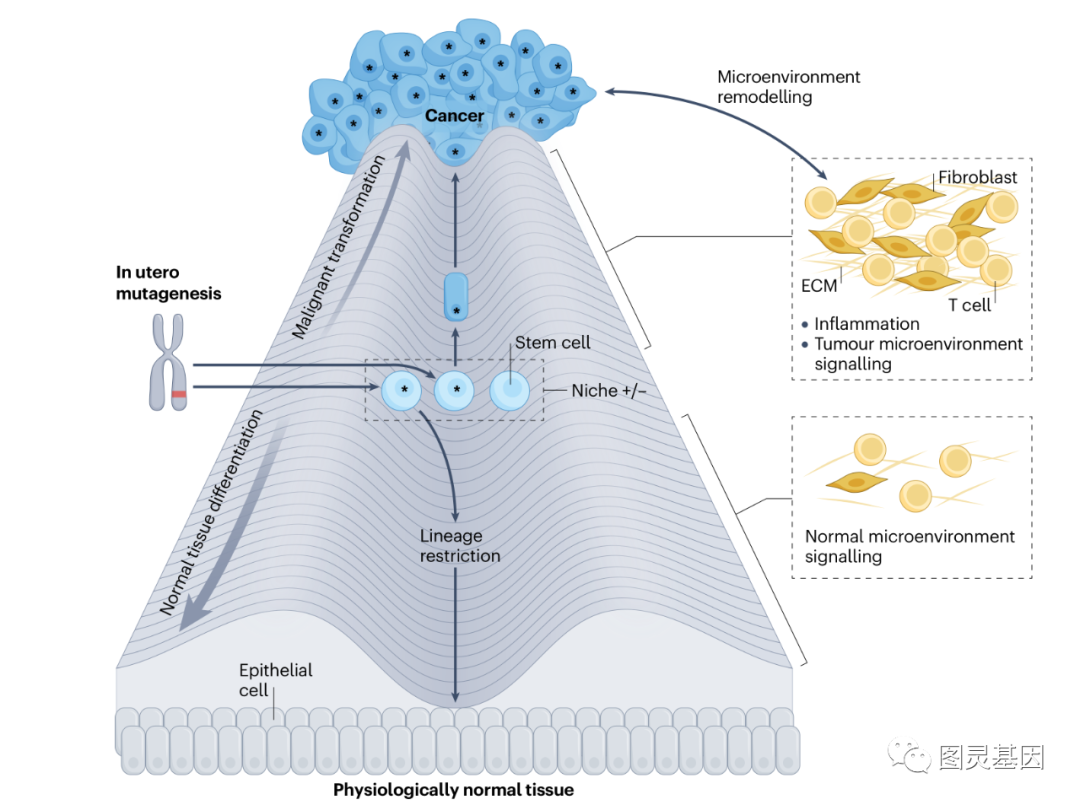
圖片:兒童癌症起(qǐ)源
1.細胞身份
了解癌症起(qǐ)源的一個基本要素是确定每種(zhǒng)組織中可以發(fā)生惡性轉化的細胞的身份。由于許多白血病和實體腫瘤都(dōu)具有分層組織結構,并由一部分自我更新的細胞亞群維持,因此幹細胞(或已獲得幹細胞樣功能(néng)的細胞,例如,在組織損傷後(hòu))被認爲是大多數組織中癌症的起(qǐ)源。
然而,流行病學(xué)和功能(néng)研究表明,癌症并不僅僅是幹細胞随機突變的結果。散發(fā)性癌症中特定組織的突變模式以及遺傳性癌症綜合征中特定器官的腫瘤形成(chéng)模式表明,細胞對(duì)轉化的敏感性不同,不同的組織被不同的緻癌突變轉化。
最清晰的例子是細胞環境如何決定患某些癌症的風險,這(zhè)些例子可在兒童惡性腫瘤中找到。兒童腫瘤通常在成(chéng)年人中不常見,因爲它們起(qǐ)源于僅存在于胚胎中的祖細胞,并且其中一些無法在小鼠模型中建立,因爲它們起(qǐ)源于人類特有的祖細胞。
細胞系譜限制性癌症易感性不僅限于兒童腦腫瘤,而且很可能(néng)決定了大多數兒童白血病和實體腫瘤,以及某些成(chéng)人癌症類型的形成(chéng)。
結合新生兒幹細胞本質上對(duì)癌症的抵抗性的證據,強調起(qǐ)始細胞的身份是癌症風險的關鍵決定因素。這(zhè)并不排除腫瘤可能(néng)是幹細胞的随機突變導緻的可能(néng)性,如“壞運氣”理論所闡述的。
2.表觀遺傳組
在細胞内部因素中,表觀基因組是癌症風險的主要決定因素,它在發(fā)育和衰老的組織中不斷重塑。事(shì)實上,調控因子的啓動子過(guò)甲基化是體外轉化細胞的特征性表觀遺傳變化,而重編程因子的短暫表達驅動轉基因小鼠中DNA甲基化和腫瘤發(fā)生的全局變化。
至少有兩(liǎng)種(zhǒng)廣泛類型的表觀遺傳變化會(huì)影響細胞狀态和癌症易感性。
第一種(zhǒng)類型涉及到在發(fā)育和衰老過(guò)程中發(fā)生的染色質和組蛋白标記的正常重塑。在胚胎中,特定的表觀基因組構型在時(shí)間和位置受限的祖細胞中準備形成(chéng)多樣化的後(hòu)代細胞,這(zhè)些細胞分布在每個器官的每個解剖環境中。與年齡相關的表觀基因組重塑也可能(néng)導緻老齡化期間癌症風險增加。在正常組織中,DNA甲基化的變化與年齡強烈相關。衰老造血幹細胞的表觀遺傳變化強化了自我更新能(néng)力,阻礙了分化,形成(chéng)了易于轉化的基因組。
第二組包括組蛋白和表觀遺傳調控因子的突變,以及腫瘤抑制基因的轉錄沉默。組蛋白經(jīng)常發(fā)生的突變改變了神經(jīng)膠質瘤、肉瘤和淋巴瘤内的表觀基因組模式,從而破壞了基本的DNA模闆相關過(guò)程,包括基因轉錄和DNA損傷修複。表觀遺傳修飾因子的突變本身可能(néng)創造了一個适合轉化的表觀遺傳狀态。關于腫瘤抑制基因的表觀遺傳沉默,這(zhè)可能(néng)包括模仿大片染色體缺失的抑制染色質廣泛區域。
因此,爲發(fā)育和衰老的組織提供生成(chéng)和維持組織可塑性的表觀遺傳重塑,可能(néng)會(huì)使這(zhè)些組織有誘導腫瘤發(fā)生的風險。
3.DNA突變
從數千個人類癌症中獲取的大規模并行測序數據表明,腫瘤平均有四到五個“驅動”突變,并且這(zhè)種(zhǒng)突變負荷随年齡增加而增加。
然而,現在可用的大量序列數據揭示了突變與癌症風險之間一個更爲複雜的關系,除了突變和幹細胞增殖之外,其他因素很可能(néng)決定一個細胞是否易于轉化爲癌細胞。
大量癌基因突變在生理正常組織中可以被耐受的觀察結果進(jìn)一步支持了這(zhè)一論點。盡管眼睑的皮膚很少形成(chéng)癌症,但這(zhè)種(zhǒng)表面(miàn)上正常的組織中有許多驅動突變的克隆,同樣,老化的肺、食管和結腸等常見的癌症發(fā)病部位也是如此。這(zhè)種(zhǒng)突變體克隆的積累很可能(néng)是老化上皮組織的一種(zhǒng)有益甚至是“正常”的特征。食管中這(zhè)種(zhǒng)克隆的出現通過(guò)細胞競争對(duì)早期腫瘤進(jìn)行清除,在保持組織完整性的同時(shí)具有抗腫瘤作用。
因此,癌症風險比以前所認識到的要複雜得多:在這(zhè)個過(guò)程中,發(fā)育、衰老和受損的幹細胞的不斷變化決定了它們對(duì)轉化突變的易感性,這(zhè)一過(guò)程與癌症的組織結構域和基态理論相一緻。這(zhè)并不意味著(zhe)撐持“壞運氣”理論的觀察是錯誤的,因爲幹細胞的增殖能(néng)力可能(néng)與其身份的其他方面(miàn)密切相關。
第四部分 細胞外在因素
Part Four ──────────────────
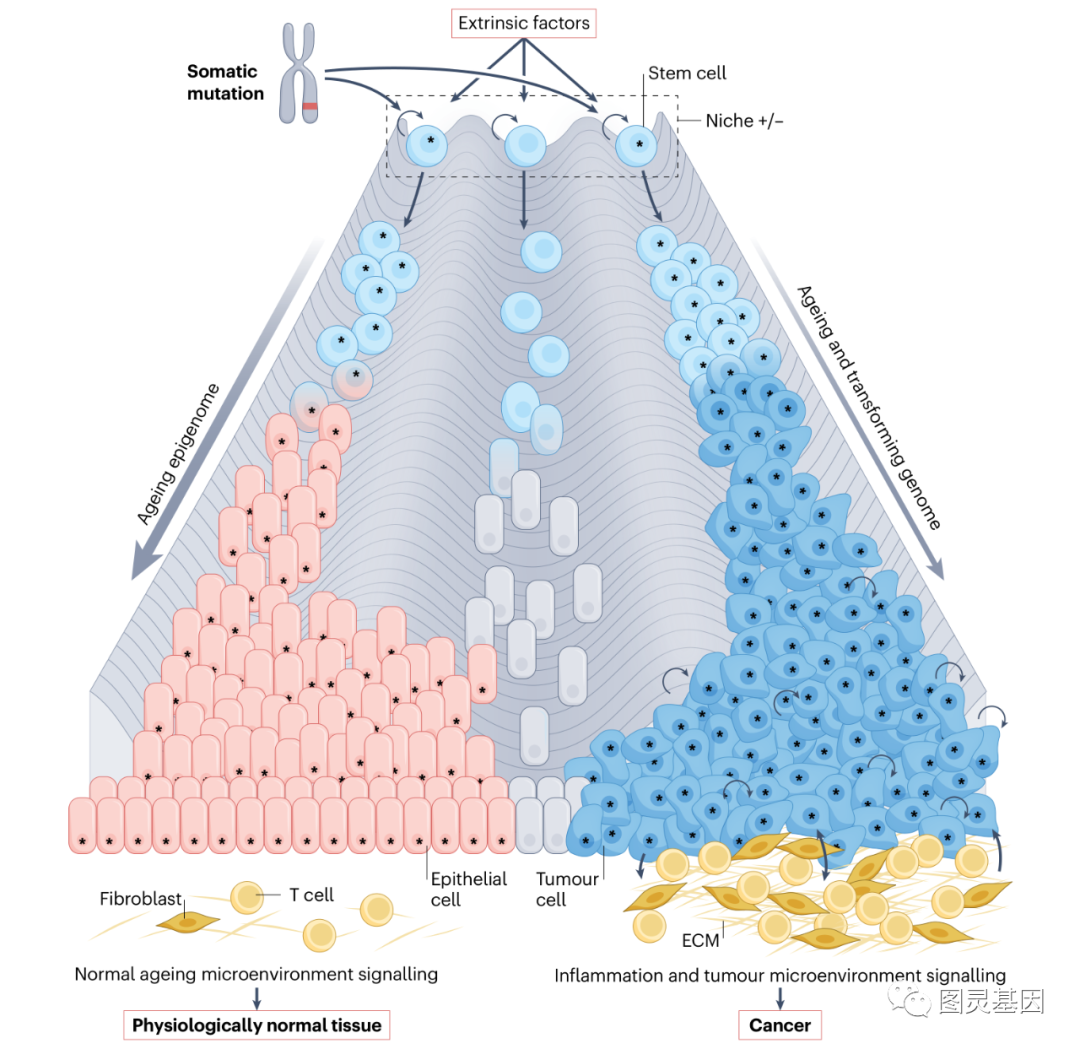
圖片:成(chéng)人癌症起(qǐ)源
1.腫瘤微環境
由于幹細胞或已經(jīng)獲得自我更新能(néng)力的細胞很可能(néng)是許多癌症的起(qǐ)源細胞,因此特定的微環境可能(néng)是癌症風險的重要調節因素。
微環境可能(néng)抑制幹細胞轉化。包裹著(zhe)幹細胞微環境的細胞外基質(ECM)中的膠原蛋白、蛋白聚糖和糖蛋白的平衡限制了它們的轉化。腫瘤間質與惡性細胞之間的相互作用可以重塑ECM,決定癌症是否進(jìn)展。因此,胚胎和新生兒幹細胞對(duì)癌症的相對(duì)抵抗力可能(néng)涉及細胞内外特性之間複雜的相互作用。
監測并清除組織中的病變和感染細胞的免疫細胞,也是癌症風險的重要調節因子。這(zhè)一觀點得到了以下證據支持:免疫抑制患者癌症的發(fā)病率增加;侵襲性癌症具有特定免疫細胞亞群浸潤;缺乏細胞毒性CD8+、輔助1型CD4+ T(T H 1)細胞和/或自然殺傷細胞的小鼠更易發(fā)展腫瘤;通過(guò)激活免疫系統殺傷癌細胞的治療方法取得了成(chéng)功。研究表明,腸道(dào)、卵巢和乳腺的成(chéng)年幹細胞會(huì)被活化的T細胞清除,而其他組織中的靜止幹細胞則抵抗T細胞殺傷。這(zhè)似乎是靜止幹細胞的内在特性,其下調抗原呈遞機制,而當幹細胞重新進(jìn)入細胞周期時(shí),這(zhè)種(zhǒng)特性會(huì)逆轉。
因此,轉化細胞與其微環境之間的通訊很可能(néng)調節表觀遺傳激活和突變幹細胞生成(chéng)癌症的能(néng)力。這(zhè)包括與癌症可能(néng)破壞和/或創造的微環境之間的複雜關系,以及與宿主免疫系統的相互作用。
2.感染與微生物
侵襲組織的微生物被認爲是癌症風險的重要外在決定因素。幽門螺杆菌是與感染相關的最常見的癌症誘因,其他四種(zhǒng)最常見誘發(fā)因素是病毒,包括人乳頭瘤病毒(HPV)、乙型肝炎病毒(HBV)、丙型肝炎病毒和EB病毒。這(zhè)些感染可以創建一個易于轉化的表觀基因組,引發(fā)基因組不穩定導緻緻癌突變,或者重塑微環境以促進(jìn)癌症形成(chéng)。
HBV通過(guò)誘導宿主基因組不穩定和病毒整合後(hòu)的表觀基因組重塑,激活癌症相關信号通路,并誘導慢性炎症,改變免疫微環境,促進(jìn)肝細胞癌發(fā)生。EB病毒是首個分離出的人類腫瘤病毒,重塑宿主細胞基因組,甲基化和下調腫瘤抑制基因。HPV編碼多種(zhǒng)蛋白,尤其是E6和E7,這(zhè)些蛋白降解或幹擾腫瘤抑制蛋白的功能(néng)。
對(duì)人類癌症的下一代測序進(jìn)一步揭示了病毒介導的轉化機制。除了導緻傳染病的細菌和病毒外,越來越多的證據表明共生微生物(總稱爲微生物群)影響癌症風險。這(zhè)一點在腸道(dào)菌群中得到了最有力的證明。在考慮癌症起(qǐ)源時(shí),确定組織中所有細胞or隻有罕見的亞群細胞(例如幹細胞)容易受到共生和/或感染介導的轉化是很重要的。
3.突變原
大規模并行測序不僅确定了癌症中發(fā)生突變的基因及其頻率,而且還(hái)能(néng)將(jiāng)這(zhè)些突變劃分爲40多個特定的突變,這(zhè)可能(néng)是由不同突變過(guò)程引起(qǐ)的。其中包括與化療藥物、紫外線(UV)照射、職業緻癌物質或内源性酶緻癌突變相關的單堿基替代的突變。這(zhè)些突變可以用來預測特定癌症類型中可能(néng)的緻癌物質。
證據顯示,其中兩(liǎng)個被稱爲“鍾表樣”的突變在從受精卵到癌細胞的整個生命過(guò)程中持續積累。這(zhè)種(zhǒng)突變的必然性與癌症起(qǐ)源的“壞運氣”理論一緻。但是,“鍾表樣”的突變并不一定通過(guò)終身幹細胞增殖來傳播。它們在不同癌症類型中的發(fā)生率差異明顯,并不總是與終身增殖能(néng)力相關。
在發(fā)育中的神經(jīng)系統中,兩(liǎng)種(zhǒng)不同的胚胎性腫瘤分别是這(zhè)些突變發(fā)生率最高(神經(jīng)母細胞瘤)和最低(髓母細胞瘤)的例子。因此,至少在某些情況下,可能(néng)存在與增殖無關的替代機制來支撐這(zhè)些突變的産生。
突變原對(duì)癌症風險的影響也可以被細胞的基态所改變。幹細胞的内在特性,包括基因組穩定性、DNA修複和細胞死亡途徑,可能(néng)會(huì)改變外源因素對(duì)癌症風險的最終影響。
第五部分 癌症風險因素的彙聚
Part Five ──────────────────
特定細胞在特定位置、特定時(shí)間脫離其正常譜系産生惡性組織的可能(néng)性很可能(néng)取決于特定背景中細胞内在和外在風險因素的彙聚。
這(zhè)個過(guò)程通過(guò)适應性表觀遺傳、可塑的細胞狀态實現,這(zhè)些細胞狀态在進(jìn)化過(guò)程中發(fā)展出來,以支持正常發(fā)育和衰老過(guò)程。這(zhè)種(zhǒng)易感性可能(néng)表現爲現有的或獲得的自我更新。通過(guò)酶、感染源、化學(xué)物質或物理突變原獲得的DNA突變呈現出異常多樣但可預測的模式,這(zhè)些突變對(duì)自我更新能(néng)力進(jìn)行了強化和破壞。細胞在向(xiàng)惡性狀态演變并與其周圍微環境之間的通訊重塑推動了腫瘤的進(jìn)展。
1.細胞内外風險因素的相互作用
重新分化是組織損傷反應的關鍵特征。雖然在不同的組織中重新分化可以采取不同的形式,但它的特點是細胞可塑性的顯著變化。重新分化甚至可能(néng)涉及到在正常組織中看不到的新細胞類型的出現。重新分化對(duì)于通過(guò)具有幹細胞樣性質的細胞群的擴張修複受損組織非常重要;但它也帶來了增加轉化機會(huì)的風險。
微環境的變化也可能(néng)促進(jìn)這(zhè)種(zhǒng)癌症風險因素的“完美風暴”。在肺部,隻有免疫系統功能(néng)正常的動物中,組織損傷會(huì)增加癌症風險。這(zhè)可能(néng)是通過(guò)巨噬細胞分泌的IL-1β介導的。因此,盡管免疫系統通過(guò)清除具有惡性潛力的突變細胞在癌症監測中起(qǐ)著(zhe)關鍵作用,但它在對(duì)組織損傷和炎症做出反應時(shí)也可能(néng)促進(jìn)癌症的發(fā)生。
在許多組織中,成(chéng)年幹細胞損傷激活與一部分回歸到祖系、不成(chéng)熟狀态有關。與幼年幹細胞相比,激活的成(chéng)年幹細胞的修複能(néng)力和抑制癌症的能(néng)力是有限的。因此,對(duì)比胚胎和損傷激活的成(chéng)年幹細胞的轉錄組可以揭示新的抑制癌症的過(guò)程。
2.轉移
大多數與癌症相關的死亡并非是由原發(fā)腫瘤引起(qǐ)的,而是轉移擴散的結果。如果從威脅人類健康的角度來考慮癌症風險,那麼(me)風險不僅僅存在于組織的轉化,還(hái)存在于其轉移的傾向(xiàng)。
類似于腫瘤發(fā)生所需的細胞易感性狀态,具有轉移能(néng)力的循環腫瘤細胞被認爲是幹細胞樣細胞。這(zhè)種(zhǒng)可塑性主要集中在上皮-間質轉化(EMT)和間質-上皮轉化(MET)的研究上,這(zhè)些轉化發(fā)生在腫瘤細胞離開(kāi)原發(fā)癌症、進(jìn)入血液循環、到達遠處部位并重新形成(chéng)腫瘤的過(guò)程。
轉移級聯可以與上遊的腫瘤發(fā)生解耦。轉移可能(néng)被視爲一種(zhǒng)被癌症“劫持”而非“創造”的正常過(guò)程。如果這(zhè)種(zhǒng)機制在人類癌症中得到驗證,那麼(me)這(zhè)些發(fā)現將(jiāng)展示出更加複雜的癌症起(qǐ)源圖景,其中組織損傷、幹細胞激活和突變共同促進(jìn)腫瘤發(fā)生和轉移。
第六部分 結論
Part Six ──────────────────
要預防癌症或在它不可治愈之前進(jìn)行有效治療,就(jiù)需要對(duì)增加惡性腫瘤風險和擴散的内外因素有全面(miàn)的理解。更好(hǎo)地理解這(zhè)些過(guò)程可以將(jiāng)癌症從目前普遍令人恐懼的疾病轉變爲可管理的、不威脅生命的疾病。
教授介紹:

Richard J. Gilbertson 教授
Richard J. Gilbertson教授在英國(guó)接受了兒科腫瘤學(xué)家的培訓,并獲得了MBBS和博士學(xué)位,于1995年成(chéng)爲皇家内科醫師學(xué)會(huì)的會(huì)員。他于2000年加入美國(guó)田納西州孩子研究醫院(St Jude Children's Research Hospital),擔任神經(jīng)生物學(xué)和腦腫瘤項目的副領導,并擔任分子臨床試驗核心的創始主任,于2011年被任命爲綜合癌症中心主任、執行副總裁和Lillian R Cannon終身講座教授。2014年,他被任命爲聖裘德兒童研究醫院的科學(xué)主任。2015年8月,他回到英國(guó),并擔任劍橋大學(xué)李嘉誠腫瘤學(xué)講座教授、腫瘤學(xué)系主任和CRUK劍橋中心主任。他的實驗室研究專注于理解正常發(fā)育與癌症起(qǐ)源之間的聯系,特别是腦腫瘤。
參考文獻:
Jassim A, Rahrmann EP, Simons BD, Gilbertson RJ. Cancers make their own luck: theories of cancer origins. Nat Rev Cancer. 2023 Jul 24. doi: 10.1038/s41568-023-00602-5.
----------THE END----------免責聲明:本文系轉載分享,文章觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!